研究範例-脂肪酸代謝
脂肪酸代謝
脂肪,現代人囤積太多的東西;因此了解脂肪如何代謝,研究如何提高脂肪代謝便成為熱門的主題。傳統研究脂肪代謝的方法為同位素標定來追蹤脂肪代謝,但同位素在操作上有危險性,因此除了需要專業的空間和訓練之外,還要定期檢測實驗人員的健康狀況。
幸運的是脂肪酸會藉由粒線體代謝,因此藉由海馬生物能量儀偵測耗氧便可以安全、方便且快速的研究不同條件下脂肪酸代謝的差別。且由於同位素的測量方法是累計的方式,因此組別間的差異反而不如海馬實驗的結果好,因此您若有脂肪代謝的實驗需求,海馬生物能量儀將是您最好的選擇。
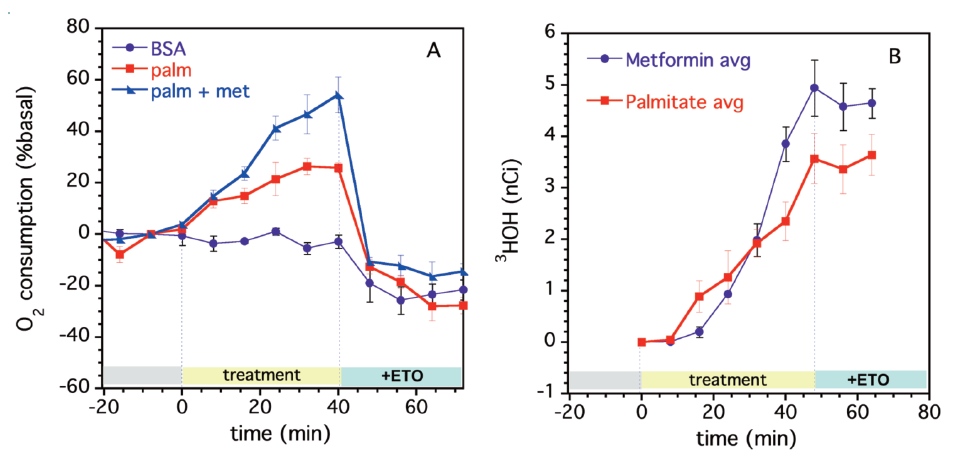
實驗設計分為1. BSA控制組 2. palm,16C棕櫚酸 3. palm + met (metformin糖尿病藥物;研究已證實為促進脂肪酸代謝)。
- 海馬實驗:可以在同一盤比較多個條件,且藉由自動注藥比較加入藥物的影響;第一次注藥可觀察到組別間因為處理不同有不同程度的耗氧提升,palm + met有最佳的反應,次之為palm,BSA則沒有反應;最後加入ETO (etomoxir,抑制脂肪酸進入粒線體),可確認被抑制的訊號為脂肪酸代謝。
- 測量9,10-3H-palmitic acid氧化後所產生的3HOH累積的情形;兩邊的實驗皆得到一致的趨勢,但海馬實驗可呈現更顯著的差異。
然而實際上進行脂肪酸實驗會面臨到許多困難,若沒有將這些困難一一克服,實驗室將無法得到正確的結果,這些需要克服的困難如下:
困難一:我平常養細胞並沒有餵細胞脂肪,我做實驗需要餵嗎?
解答一:
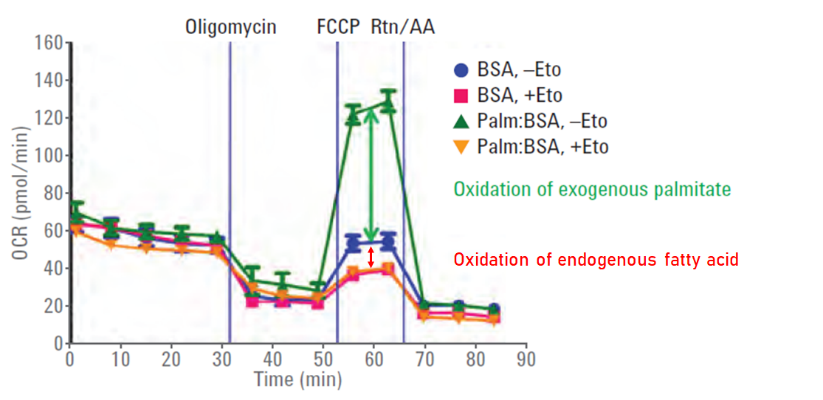
若細胞會合成脂肪提供給自己代謝,加入Eto便可區分脂肪酸代謝的耗氧,此部分屬於內生性脂肪酸代謝;而完整的實驗必須要額外加入脂肪酸才可以評估外生性的脂肪酸耗氧。
藉由粒線體壓力測試與不同組別的實驗設計,可有效區分外生性與內生性脂肪酸的比例;但大部分的細胞並無內生性脂肪酸。
困難二:脂肪酸應該怎麼加才正確? 為何我加入脂肪酸濃度越高細胞死亡率越高?
解答二:
由於脂肪酸不溶於水,因此必須與BSA進行鍵結才可有效提高溶解度,與BSA鍵結需要長時間的攪拌,不同階段攪拌的溫度也有所不同;且在構上一分子的BSA僅能與六分子的棕櫚酸結合,因此若濃度或是過程不正確還會同時產生許多free fatty acid;因此實驗室若無正確鍵結BSA-Palm,隨著濃度越高會有越多free fatty acid造成細胞氧化壓力,這也是為何隨著加入脂肪酸濃度越高,細胞死亡率也隨之增加的原因。
Agilent Seahorse提供確實與BSA鍵結的16C棕櫚酸,且每批號會測量free fatty acid濃度,以確保對細胞不會有不良影響。
困難三:代謝的優先順序是碳水化合物>脂肪>蛋白質,我要如何設計實驗?
解答三:
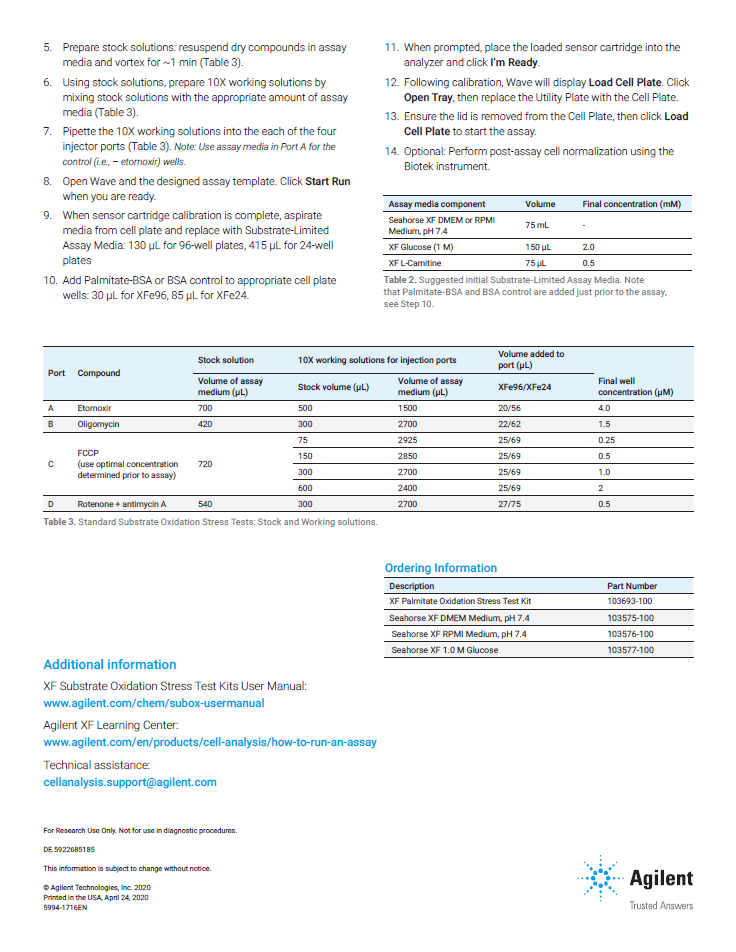
為了讓細胞在實驗進行時可以確實進行脂肪酸代謝,實驗前會先將細胞置於substrate-limited medium (0.5mM glucose),讓細胞處於糖近乎耗盡的狀態一陣子,而這段時間的長度需視細胞代謝特徵而定,例如癌症細胞因為過於依賴glucose,因此時間需較短,約4小時即可;若屬於較不依賴glucose的心肌細胞,則需處在此環境隔夜才有較好的效果;之後才會置換成海馬上機用培養基正式進行測試。
脂肪酸代謝屬於難度較高的實驗,建議已有粒線體壓力測試的經驗再進行;原廠提供了完整的操作流程文件與相對應的試劑,尚博也提供良好的技術支援,若您有此實驗的需求,歡迎與我們聯絡!

